研究概要 >> Research (English)
π共役分子は、1)二重結合性に由来して結合エネルギーが大きく回転の自由度が少ないことから剛直な分子骨格を持つ、2)π共役電子に基づいて光や酸化還元への応答を示す、といった特徴を持ち、有機機能性材料の中核を占める分子群です。
有機材料を非溶液系で利用する際にはπ共役系自体の設計と並んで、分子の集合構造が鍵となります。しかし、π共役骨格は平面的な分子が大半を占める構造多様性に乏しい状態であり、重なりやすい平面π共役分子に周辺修飾を施すことで集合構造を変化させる手法等が採られています。これに対して私達は、立体性を持つ新たなπ共役骨格を設計・合成して三次元構造を組み上げることを目指して研究を進めています。
また、通常は積層等によってアクセス困難になるπ共役面は、立体π共役分子とすることで面上下に空間を残して集合する状況を作り出せます。この状況を利用するなど、π共役系の「面内での共役」ではなく「面外方向での分子間相互作用」に着目した機能開拓の研究にも取り組んでいます。
・ねじれ運動でπ共役系材料を可溶化・非晶化する
・立体骨格でπ共役面の上下に空隙を作り出す
・後期直接修飾によって大環状ホスト分子に発光性を持たせる/共同物性を発現させる
これまでの研究記録
以下では、既に学術論文として公開済みの研究例を現場目線でご紹介します。
π縮環プロペランを立体骨格として利用する(生越研究室, 2020/06 - present)
トリプチセンが立体骨格として広く活用される一方で、同様の分子構造を持つ縮環プロペランは立体骨格としての利用が限定的でした。ビフェニルが縮環した[4.4.4]プロペランは1971年、ナフタレンが縮環した[3.3.3]プロペランは1993年に合成が報告された歴史ある分子ですが、効率的な合成法の開発が遅れたことから研究例は少ない状況にあり、ブロモ化を足掛かりとしたπ拡張分子の合成例などに限られていました。
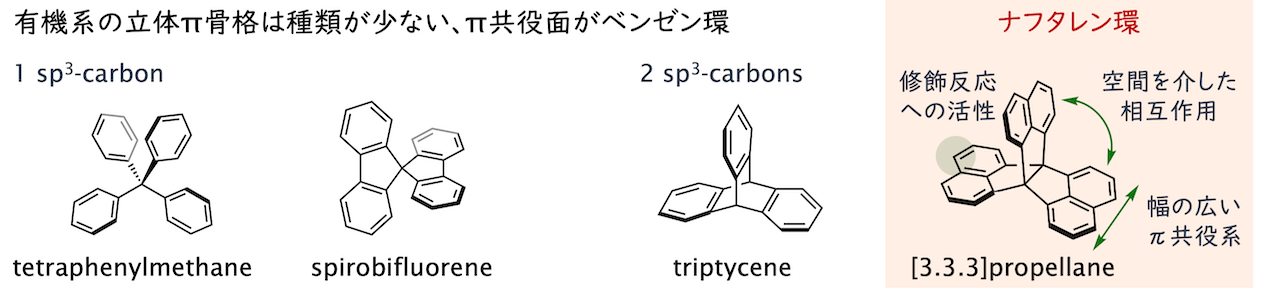
新しい修飾法の開拓(2020/06 - )
立体骨格としてよく利用されるトリプチセンやテトラフェニルメタンが持つベンゼン環よりも反応活性なナフタレン環を有する点に着目し、求電子置換反応などの開発を進めています。特に、ニトロ化によって選択的に得られるヘキサニトロ体は還元によって定量的にヘキサアミノ体へと誘導でき、様々な有機構造体の構成単位として有望な分子です(BCSJ 2022)。ビフェニルが縮環した部位によって反応性に差を設けることで非対称化反応も可能にしています(CC 2023)。
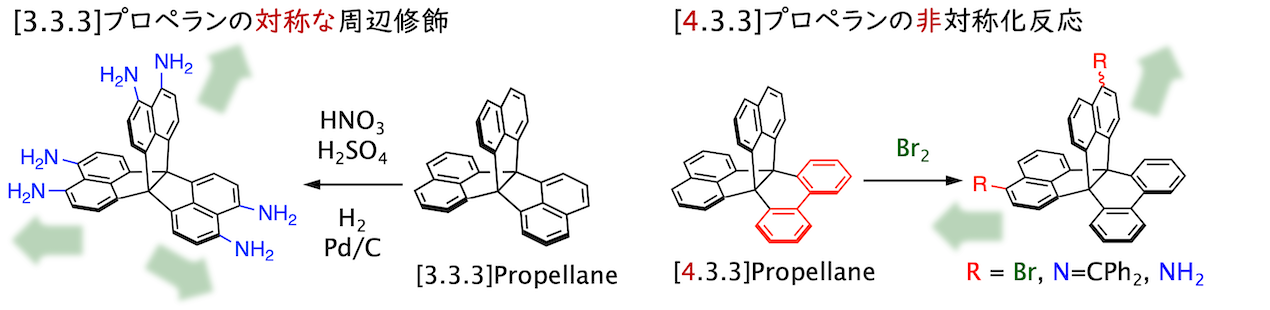
立体骨格に基づく特性(2020/08 - )
縮環プロペランは他の立体骨格よりも広いπ共役系を持つため、ポケット部位での多点CH/π相互作用に基づく小分子認識が有望視されます。2022年現在、300 Pa以下の低圧領域でC4以上のアルカンを高選択的に単層吸着することを見出しており(BCSJ 2022; CL 2022)、アルカン吸着における選択性の解明や分子設計による選択性の制御を目指して研究を推進しています。
キラル骨格としての活用(CC 2023)や周辺置換基への依存度が低い特異なフィルム形成挙動(CAJ 2024)など、立体骨格ならではの特性開拓にも取り組んでいます。
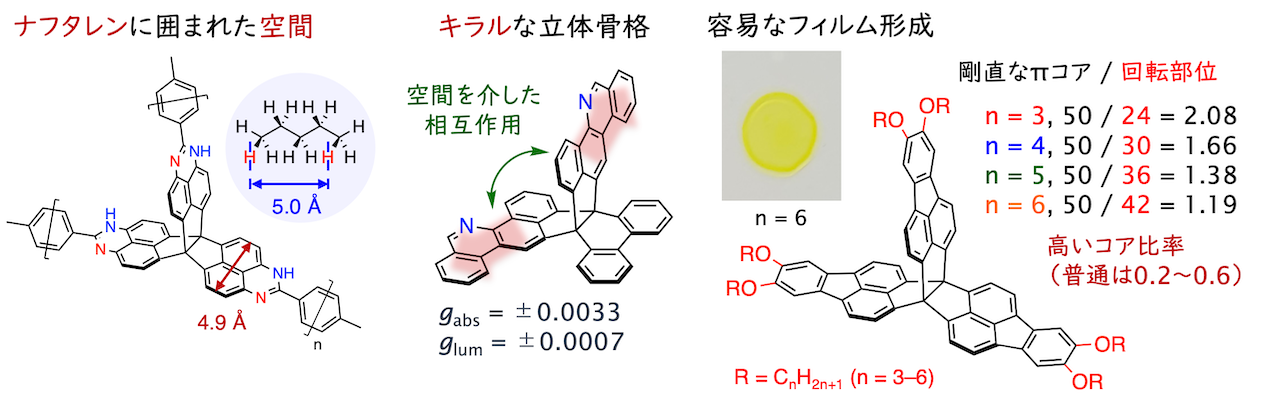
ねじれ運動の評価と活用(2022/06 - )
また、トリプチセンが分子軸外側へのC–H結合を持つ代わりに、プロペランは分子内部にC–C単結合を持ちます。この違いは分子軸周りのねじれ運動に大きく影響し、縮環プロペランは分子が密に詰まった結晶構造を作りにくく、非晶性や高い溶解性を示す傾向にあります。この関係は平面分子に対する擬平面・曲面分子の関係に対応しており、密に集積化しやすいトリプチセンでは実現しにくい柔らかい材料への展開が期待されます。
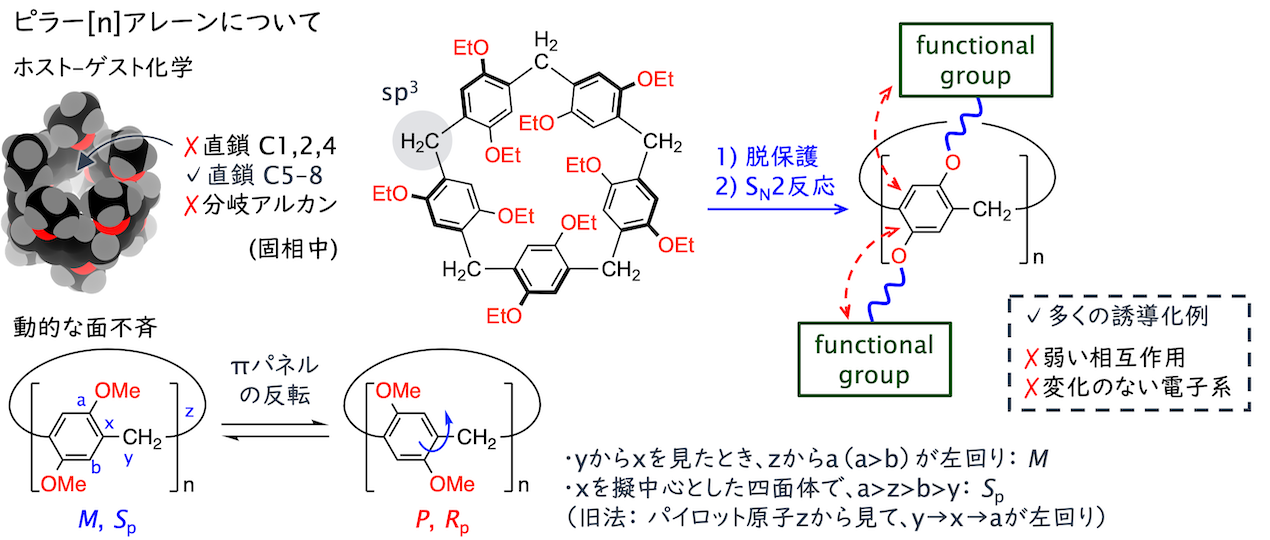
ピラー[n]アレーン化学を構造有機化学の観点で(生越研究室, 2020/04 - present)
ピラー[n]アレーンは1,4-ジアルコキシベンゼンがメチレンを介して環状に連結した分子で、対称的な柱構造をとるほか、斜め方向の置換基に由来する面不斉を示す点が特徴的です。ピラー[n]アレーンはホスト–ゲスト化学の文脈で扱われることが多く、π共役系として分子構造や電子状態に着目して研究されることは稀でした。また、アルコキシ置換型の化合物が大半を占め、電子状態を改変できる環骨格への直接修飾は例が乏しい状況が続いていました。
電荷密度を改変したピラー[n]アレーン(2020/04 - )
under construction
(関連論文:Adv. Funct. Mater. 2024)
キラル光学特性における構造-物性相関(2020/04 - )
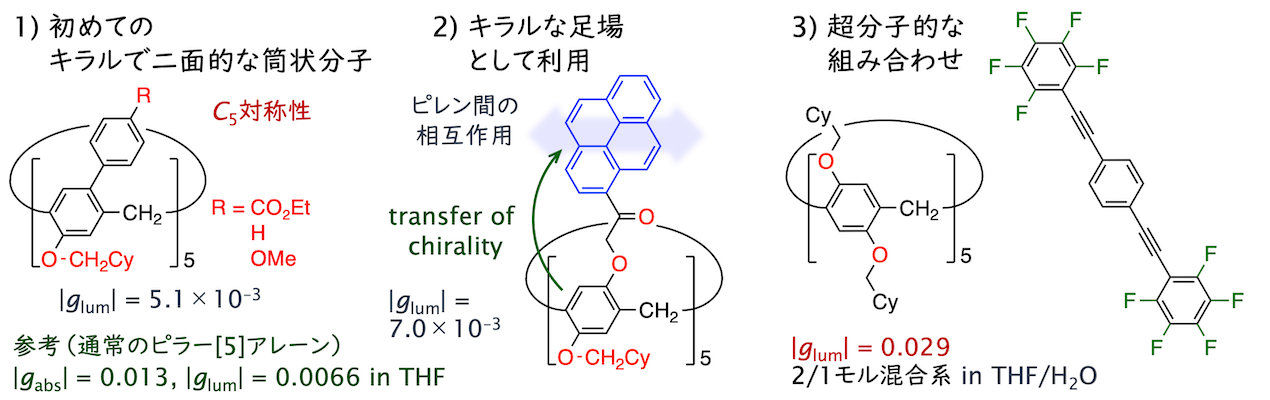
面不斉に由来したキラル光学特性はホスト–ゲスト錯体形成に伴う応答性へ注目が集まる一方で、「応答強度」に着目した研究はなされてきませんでした。ピラー[n]アレーンは強いキラル光学応答を与える分子骨格として近年高い注目を集めている大環状分子に該当し、円筒構造の両縁に自在に置換基を導入できるという稀有な利点を有しています。そこで私達は、C5主軸を保ったまま片縁の反応点すべてにアリール置換基を導入した分子群を創出し、キラル光学応答の性能を特徴づける非対称性因子について、ピラー[n]アレーン分子系としての最高値を大きく更新しました(ACIE 2022)。また、二面性を持つキラル大環状化合物の系統的な調査は本研究が初めての例で、分極構造が明確になるにつれて非対称性因子が低下する挙動を明らかにしました。ピラー[5]アレーンの特長を組み合わせた異なる分子系の開発にも取り組み、キラル光学応答の更なる性能向上を達成しました(CS 2022; Aggregate 2024)。
(関連論文:CS 2022; Nat. Commun. 2022; JACS 2024)
・面不斉の自発的整列に関する総説:K. Kato, S. Fa, T. Ogoshi, Angew. Chem. Int. Ed. 2023, 62, e202308316.
両縁すべての修飾位置に芳香族置換基を連結することにも初めて成功しました(JACS 2023)。通常のアルコキシ型ピラー[n]アレーンは面不斉の揃った柱構造を安定配座としていますが、合成した分子群は酸素原子が置き換わったことで面不斉の異なる立体異性体の組が存在すること、柱構造がつぶれた複数の配座を柔軟に相互変換することが分かりました。通常のアルコキシ型ピラー[n]アレーンがもつホスト機能は示さない一方で、剛直でπ拡張された単位構造に由来して高い発光性を示しました。
ポルフィリンの周辺修飾(大須賀研究室, 2014/04 - 2020/03)
ケイ素置換型ポルフィリン
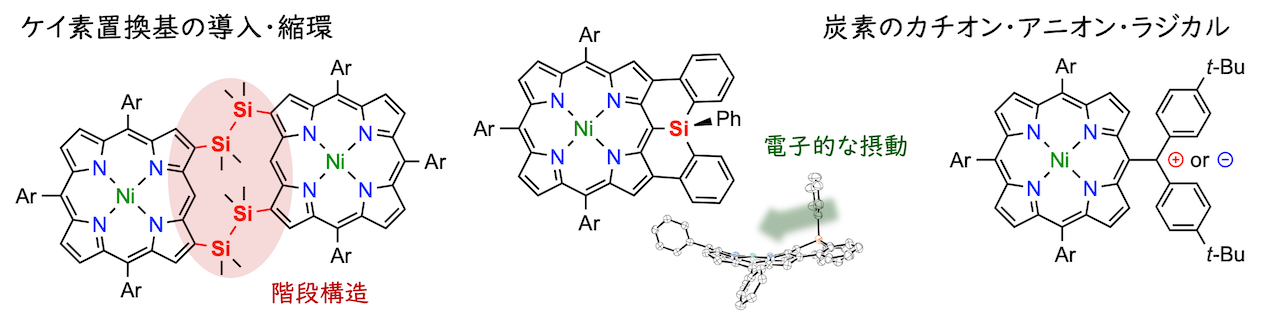
大須賀篤弘教授・依光英樹准教授のご指導のもと、ポルフィリンの周囲にケイ素置換基を直接結合させた分子群を合成するというテーマで研究を開始しました(CEJ 2015)。実験操作を教わったのは藤本圭佑さん(2年先輩)で、高求核的なポルフィリン金属種(Eur. JOC 2014; CEJ 2015)を利用した新規分子の合成研究を暖簾分けしてくださいました。藤本さん・福井識人さん(同じく2年先輩)らと一緒にB,N,Si,Pといった典型元素を組み込んだポルフィリンの化学を展開できたのは大きな幸運でした。続く研究では、分子内の求電子的な反応を用いて縮環構造をもったケイ素置換ポルフィリンの合成を行いました(CAJ 2016、ちなみに分子間での反応はポルフィリンの数少ないベータ位選択的反応になっています)。ケイ素では縮環体においても電子的な摂動が小さかったため、同族元素である炭素のカチオン・アニオン・ラジカルを付けてみるなど(CEJ 2016)、元素ではなく結合の組み上げ方で新規分子を作り出す方向性に興味が移っていきました。
・ヘテロ原子縮環型ポルフィリンの総説:N. Fukui, K. Fujimoto, H. Yorimitsu, A. Osuka, Dalton Trans. 2017, 46, 13322.
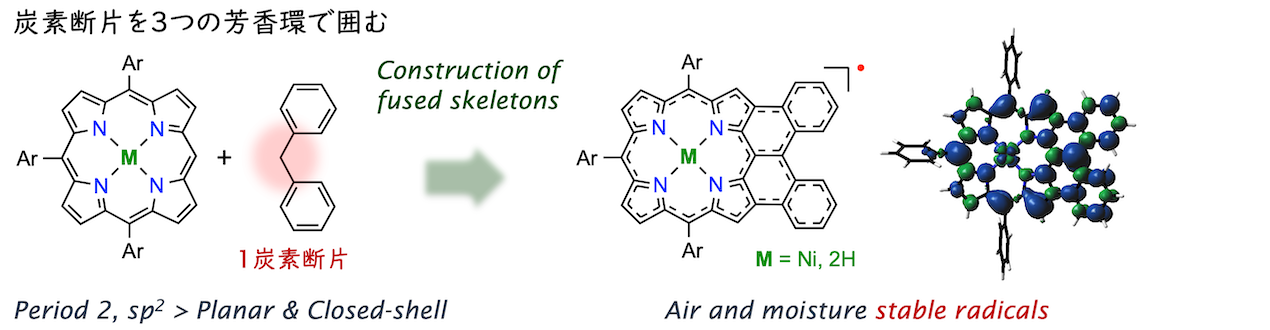
炭素中心ラジカル
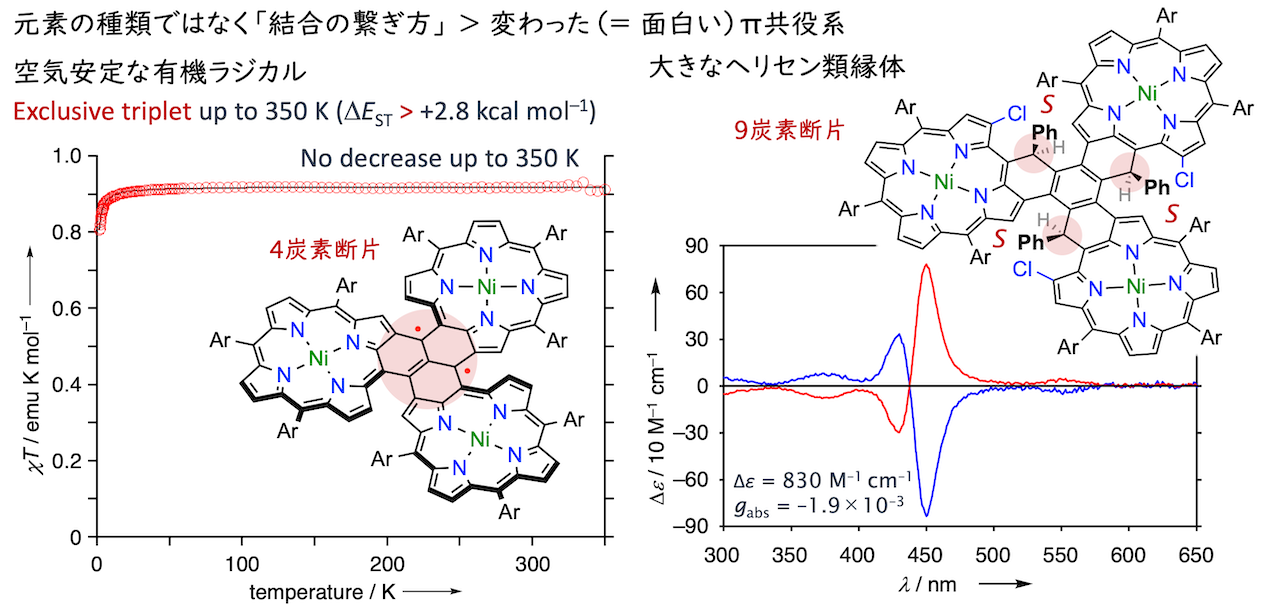
ポルフィリンの隣接位にジフェニルメチル基を導入した分子系で縮環反応を検討したところ、埋め込まれた炭素上の水素が特別な処理無しに失われて安定ラジカル種を生じることが分かりました(ACIE 2016)。当時は、清水大貴さん(1年先輩)が酸素ラジカルの化学を再発見した時期でしたが(ACIE 2015)、酸素や二量化に弱い炭素中心ラジカルでも通常の有機分子並みに安定だったのは予想外でした。その後は、ポルフィリン共役系へのスピン非局在化の観点から安定性や磁性相互作用を説明する研究を進めました。ポルフィリンを用いて通常の平面π共役系と異なる(スピンや空間の反転対称性を破った)電子系を創出することを軸に、螺旋型で空気安定な中性ラジカル(CEJ 2018)、化学安定性と熱安定な高スピン状態を両立した炭素中心ジラジカル(ACIE 2018)、スピンの非局在化による開殻性の顕在化(ACIE 2019)、螺旋構造の縮環ポルフィリン多量体(CL 2020; CEJ 2020)に関する研究をまとめて博士の学位を取得しました。
残念ながら合成・単離には至りませんでしたが、安定な三重項カルベン種の合成にも取り組みました(大須賀先生による科研費報告書)。
(関連論文:CAJ 2019; ACIE 2020; ACIE 2021)
・ポルフィリノイドに基づく安定ラジカルの総説:D. Shimizu, A. Osuka, Chem. Sci. 2018, 9, 1408.
・安定な炭素中心ラジカルの総説:K. Kato, A. Osuka, Angew. Chem. Int. Ed. 2019 58, 8978.
・ポルフィリノイドに基づくジラジカル種の総説:K. Kato, A. Osuka, Diradicaloids (Ed.: J. Wu), 2022, pp. 453-503
*本ページの所属・役職名は、基本的に当時のものです。
Research >> 研究概要(日本語)
Main achievements and related reviews are listed as follows:
Fully π-fused propellanes
・Hexa-nitrated and aminated trinaphtho[3.3.3]propellanes: BCSJ 2022
・Fundamentals and chirality inversion: CEJ 2024
・Gas/vapor-adsorption materials: BCSJ 2022, CL 2022
・Unsymmetric functionalization for chiral center: CC 2023
・Amorphous, glass, and film materials: CAJ 2024
Pillar[n]arenes
・CD and CPL spectra of common alkoxy pillar[5]arene: ACIE 2022, Aggregate 2024
・The first discrete macrocycles with chirality and two sides : ACIE 2022
・C5/D5-symmetry for chiroptical molecular systems: CS 2022, Aggregate 2024 (CS 2022; Nat. Commun. 2022; JACS 2024)
・Direct and full substitution with aryl substituents : JACS 2023, CS 2024
・Close interplay with functional units : BCSJ 2024
Review
・Alignment of planar chirality: K. Kato, S. Fa, T. Ogoshi, Angew. Chem. Int. Ed. 2023, 62, e202308316.
Porphyrins
・Direct introduction and fusion of Si substituents: CEJ 2015, CAJ 2016
・Direct attachment of a trivalent carbon (cation and anion): CEJ 2016
・Carbon-centered and related air-stable radicals: ACIE 2016, ACIE 2018, ACIE 2019 (CAJ 2019, ACIE 2020, ACIE 2021)
・The first air-stable neutral radicals delocalized over helically chiral π-systems: CEJ 2018
・Giant helicene analogues: CL 2020, CEJ 2020
Review and book chapter
・Heteroatom-fused porphyrins: N. Fukui, K. Fujimoto, H. Yorimitsu, A. Osuka, Dalton Trans. 2017, 46, 13322.
・Porphyrinoid-based stable radicals: D. Shimizu, A. Osuka, Chem. Sci. 2018, 9, 1408.
・Stable carbon-centred radicals: K. Kato, A. Osuka, Angew. Chem. Int. Ed. 2019 58, 8978.
・Porphyrinoid-based stable diradicals: K. Kato, A. Osuka, Diradicaloids (Ed.: J. Wu), 2022, pp. 453-503
Further information...
Organic and polymeric functional materials generally use π-conjugated systems as core components because of the well-defined structures and indispensable electronic properties for photophysical, electrochemical, and other responses. Due to the rigid planar shapes, π-conjugated systems themselves show poor solubility and a tendency to form π/π-stacked dimers and one-dimensional (1D) assemblies. They often need to be equipped with flexible substituents to improve the solubility and enable solution processing. However, solid-sate properties of functional materials depend on the modes of molecular assembling. Such situations reduce the diversity of molecular assembling. Developments are desired in the field of three-dimensional (3D) π-skeletons beyond conventional combination of a functional planar π-core and flexible moieties on the periphery.
Macrocyclic arenes possess unique symmetric 3D structures due to alternating aromatic and methylene units, unlike planar π-conjugated systems. Whereas recent efforts led to a lot of new scaffolds, really useful macrocycles are highly limited because they require high yields and selectivity in macrocyclization as well as suitable conformations for aimed functions. In addition, the presence of methylene units interrupts inter-unit conjugation between aromatic units, giving relatively poor π-electronic properties. For these situations, we have used an established macrocyclic arene composed of 1,4-dialkoxybenzene units, pillar[n]arene, and performed late-stage functionalization toward drastic changes of the electronic properties. Whereas pillar[n]arenes are poorly fluorescent, covalent and supramolecular combination of π-conjugated systems gave circularly polarized luminescence (CPL) due to pillar[n]arene chirality transmitted to the π-systems arranged in 3D space. Direct replacement of alkoxy substituents with aryl ones produced the first discrete cylinder with stable chirality and two sides and fully arylated pillar[n]arene derivatives. The latter exhibited new stereoisomers/conformations, different guest-inclusion abilities, and efficient luminescence.
The bowl, cylinder, and other 3D structures of macrocyclic arenes are derived from alternating sp3 carbon atoms in macrocyclic chemical structures. Instead, spiro- and bicyclo-structures comprised of sp3 atoms can give well-defined 3D π-cores such as spirobifluorene and triptycene. Such versatile 3D π-cores have frequently incorporated into organic, polymeric, and hybrid materials for diverse research fields, but their variety has been limited to a few skeletons. Fully π-fused [3.3.3]propellane has a tricyclo[3.3.3.0] skeleton and triptycene-like 3D shape. Its π-extended naphthalene rings should be beneficial for late-stage modification in mild conditions and interactions using the π-surfaces. In fact, we developed selective six-fold symmetric functionalization to synthesize network polymers and hydrogen-bonding molecular solids with component-dependent adsorption properties toward small-molecule gases and vapors.
By replacing the naphthalene moieties with biphenyl ones, fully π-fused propellanes can offer total 4 different 3D structures with variable twisting of the central C–C single bonds. Our study revealed that the twisted enantiomers of all-biphenyl-fused [4.4.4]propellane were extremely stable even at high temperature without the aid of substituents. The chiral [4.4.4] skeleton is also highly symmetric and easy-to-synthesize/functionalize, being an ideal intrinsically chiral π-core. With less biphenyl moieties, twisted conformations caused dynamic inversion of chirality. All-naphthalene-fused [3.3.3]propellane took a non-twisted conformation in theoretical calculations, but the degree of allowed twist was much greater than that of triptycene. The insight gave a reason for recent finding that a series of fully π-fused propellanes formed amorphous films against unusually high content of a well-defined π-core. The large reduction of peripheral substituents should have impact on films, glasses, adhesives, and solution-processable materials.